 Όπως οι περισσότεροι γνωρίζουν, ο Ελληνικός Οργανισμός Φαρμάκων (ΕΟΦ)
είναι υπεύθυνος για την ασφάλεια και τη ποιότητα των φαρμακευτικών
προϊόντων που κυκλοφορούν στην Ελληνική αγορά. Ο εθνικός αυτός
οργανισμός είναι ο μοναδικός στην Ευρωπαϊκή Ένωση που δεν δημοσιεύει τα επίσημα στοιχεία της φαρμακοεπαγρύπνησης, ως οφείλει με βάση το άρθρο 133 της Κ.Υ.Α 32221/2013.
Όπως οι περισσότεροι γνωρίζουν, ο Ελληνικός Οργανισμός Φαρμάκων (ΕΟΦ)
είναι υπεύθυνος για την ασφάλεια και τη ποιότητα των φαρμακευτικών
προϊόντων που κυκλοφορούν στην Ελληνική αγορά. Ο εθνικός αυτός
οργανισμός είναι ο μοναδικός στην Ευρωπαϊκή Ένωση που δεν δημοσιεύει τα επίσημα στοιχεία της φαρμακοεπαγρύπνησης, ως οφείλει με βάση το άρθρο 133 της Κ.Υ.Α 32221/2013.
Λόγω της άρνησης δημοσίευσης των δεδομένων από πλευράς της Ελληνικής κυβέρνησης, απευθυνθήκαμε στις 8 Αυγούστου 2022 για ακόμα μία φορά στον Ευρωπαϊκό Οργανισμό Φαρμάκων (ΕΜΑ), ώστε να μας παραδώσει τα στοιχεία που ο ΕΟΦ αρνείται να δημοσιεύσει. Μετά από καθυστέρηση αρκετών μηνών (χρειάστηκε να απευθυνθούμε στον Ευρωπαϊκό Διαμεσολαβητή), λάβαμε επιτέλους τα δεδομένα που ζητήσαμε.
Το dataset που λάβαμε περιλαμβάνει όλες τις αναφορές ανεπιθύμητων ενεργειών (ADR’s) για τα προϊόντα κατά της Covid-19 στην Ευρωπαϊκή βάση δεδομένων Eudravigilance και
συμπεριλαμβάνει τη χώρα προέλευσης της κάθε αναφοράς από τις 10.12.2020 μέχρι και τις 05.08.2022. Να τονίσουμε ότι η βάση δεδομένων του ΕΜΑ δεν παρέχει ένα φίλτρο με τη δυνατότητα εξαγωγής της κάθε αναφοράς με βάση της χώρα προέλευσης. Ουσιαστικά, “κατεβάζουμε” τη βάση δεδομένων από τη σελίδα του Eudravigilance και τη στέλνουμε πίσω στον οργανισμό, ζητώντας να προσθέσουν τη χώρα προέλευσης. Η διαδικασία διαρκεί περίπου 2-3 μήνες και θα μπορούσε πολύ εύκολα να αποφευχθεί, αν ο ΕΜΑ ήθελε να είναι λίγο περισσότερο διαφανής. Η αλλαγή στο Dashboard του συστήματος (κατασκευής Oracle) διαρκεί 5 λεπτά και μερικά κλικ….Ελάχιστη χρήση της “κίτρινης κάρτας” στην Ελλάδα
Τα δεδομένα περιλαμβάνουν 11.884 αναφορές από τον Ελλαδικό χώρο μέχρι και τις 05.08.2022. Αναλογικά με άλλες χώρες, είναι φανερό ότι ένα μεγάλο μέρος του ιατρικού προσωπικού της χώρας εσκεμμένα αδιαφορεί και οι πολίτες δεν είναι ενήμεροι για τη χρήση της “κίτρινης κάρτας“.
| Χώρα | Πληθυσμός | Δόσεις ανά 100 κατοίκους | Αριθμός αναφορών ανεπιθύμητων ενεργειών |
| Ελλάδα | 10.423.054 | 200,1 | 12.263 |
| Ολλανδία | 17.134.872 | 207,4 | 229.510 |
| Βέλγιο | 11.589.623 | 224,1 | 40.267 |
| Πορτογαλία | 10.196.709 | 244,2 | 38.271 |
| Σουηδία | 10.099.265 | 215,9 | 69.502 |
| Τσεχία | 10.708.981 | 168,1 | 16.787 |
| Αυστρία | 9.006.398 | 216 | 170.715 |
Ο ίδιος ο ΕΟΦ φαίνεται ότι δεν ασχολείται με το θέμα της φαρμακοεπαγρύπνησης για προϊόντα που δεν έχουν δοκιμαστεί ποτέ στο γενικό πληθυσμό και αρκείται στη δημοσίευση μεταφρασμένων ανακοινώσεων που προέρχονται απευθείας από τον ΕΜΑ.
Ανησυχητικό είναι το γεγονός ότι μία ιδιωτική εταιρεία συμβούλων (μία από τις μεγαλύτερες του πλανήτη) έγραψε την μία και μοναδική αναφορά Φαρμακοεπαγρύπνησης για λογαριασμό του Εθνικού Οργανισμού Φαρμάκων. Ο ΕΟΦ απλά την πήρε έτοιμη και την δημοσίευσε στην ιστοσελίδα του.
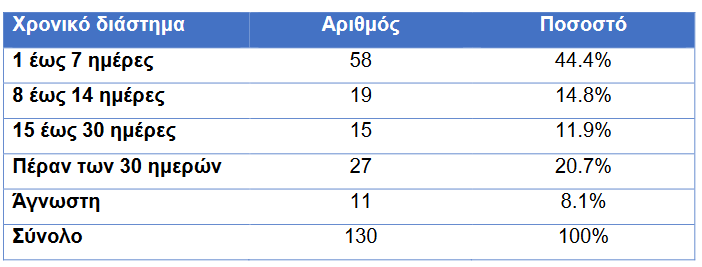
Σύμφωνα με την αναφορά αυτή, οι περισσότερες θανατηφόρες ανεπιθύμητες ενέργειες εμφανίζονται τις πρώτες 7 ημέρες από τη δόση (44,4%) και ακολουθούν με 20,7% οι αναφορές που αφορούν θανάτους που δηλώθηκαν πέραν των 30 ημερών από τη δόση.
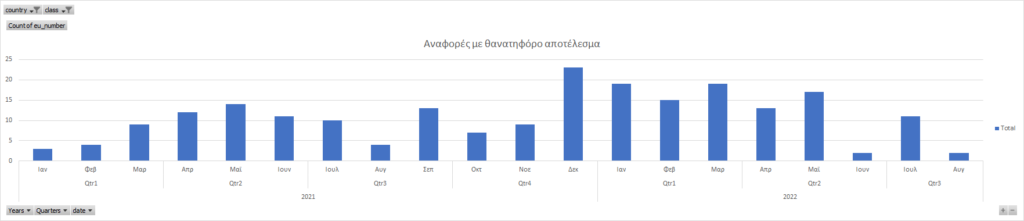

Παρατηρούμε ότι υπάρχει αλληλουχία μεταξύ του ρυθμού των χορηγούμενων δόσεων και των θανατηφόρων αναφορών στον ΕΜΑ. Κανείς βέβαια δεν μπορεί να προβλέψει τι θα συμβεί τα επόμενα χρόνια και αν η νέα τεχνολογία που χρησιμοποιείται, θα έχει ολέθρια αποτελέσματα στην υγεία των πολιτών.
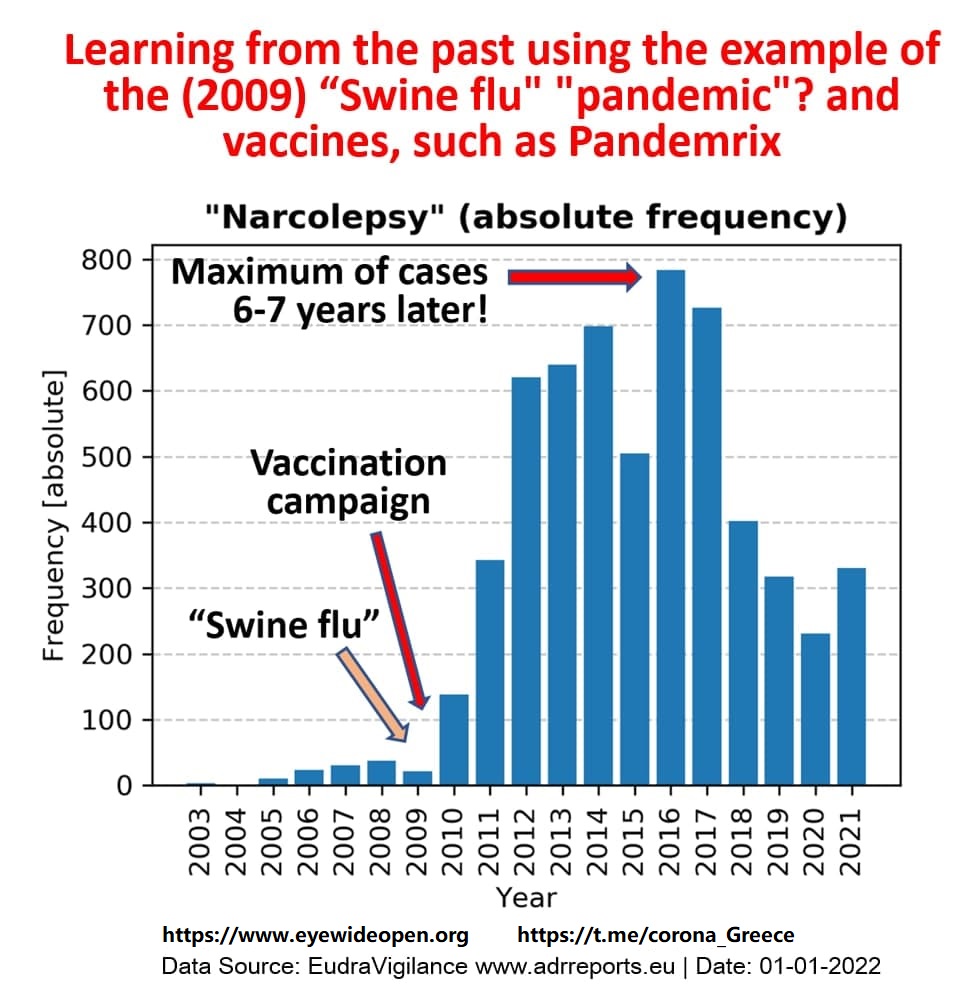
Να θυμίσουμε εδώ ότι οι εμβολιασμοί κατά της γρίπης των χοίρων ξεκίνησε μόλις το 2010(ένα χρόνο μετά την εμφάνιση της τότε “πανδημίας”), αλλά η κορύφωση στις αναφορές ναρκοληψίας επιτεύχθηκε μόλις μετά από 6-7 χρόνια. Για την ιστορία, το Pandemrix αποσύρθηκε από την αγορά.
Είναι επίσης σημαντικό να σημειωθεί ότι σύμφωνα με την αυστριακή φαρμακευτική ένωση Pharmig, το ποσοστό των καταγεγραμμένων πραγματικών αναφορών ανεπιθύμητων ενεργειών εμβολιασμού κατά της Covid κυμαίνεται στο 6%. Σύμφωνα με μια μετα-μελέτη των Hazell et al. – οι οποίοι αξιολόγησαν 37 μελέτες για το θέμα αυτό – ο μέσος όρος της υπο-αναφοράς στις φαρμακευτικές βάσεις δεδομένων ADR ήταν 94%.
Συνεπώς, το ποσοστό αναφορών που θα έπρεπε να δηλωθεί πρέπει να εκτιμηθεί ως υψηλό: 94-97% μη δηλωθέντων πιθανών ανεπιθύμητων ενεργειών φαρμάκων “λείπουν” από τη βάση δεδομένων της φαρμακοεπαγρύπνησης.
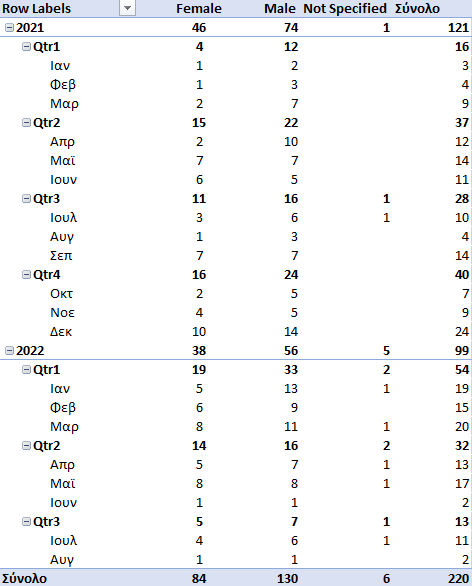
220 νεκροί, μία (ακόμα;) θανατηφόρα αναφορά για ανήλικο ηλικίας 12-17 ετών
Σύμφωνα με τα δεδομένα που μας απέστειλε ο ΕΜΑ, στην ηλικιακή ομάδα 12-17 ετών υπάρχει μία αναφορά για έναν νεκρό μετά τον εμβολιασμό με το προϊόν των BioNTech/Pfizer.
Πρόκειται για την αναφορά EU-EC-10011481066 που υποβλήθηκε στον ΕΜΑ στις 03.02.2022 και στην οποία υπάρχει απλώς το αποτέλεσμα: αιφνίδιος θάνατος (α/α – θανατηφόρο – οδηγεί σε θάνατο, άλλη ιατρικά σημαντική κατάσταση).
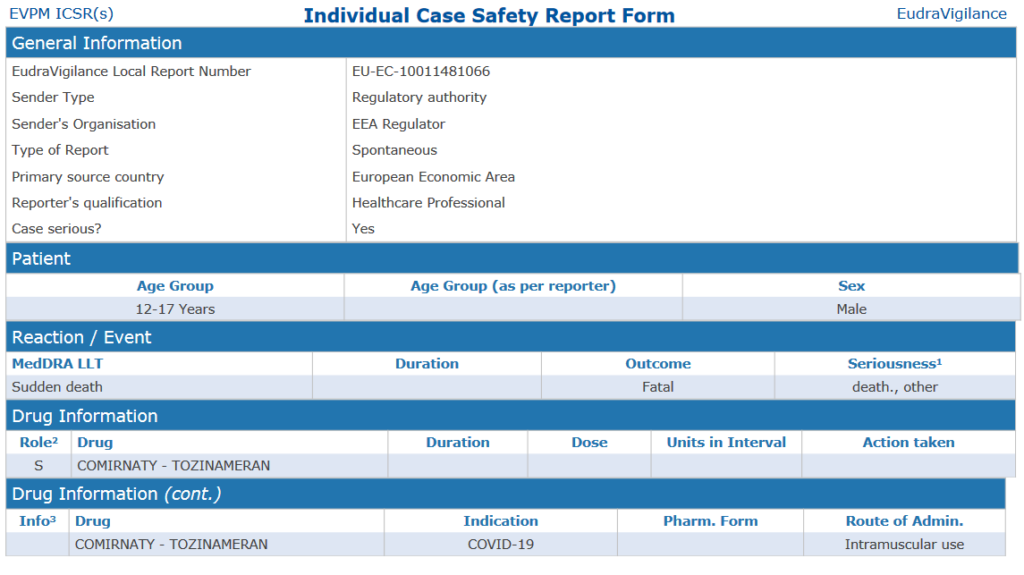
Η φόρμα ICSR φαίνεται παρόμοια με την αναφορά EU-EC-10010009963 που είχε υποβληθεί στον ΕΜΑ στις 15.09.2021 και δεν υπάρχει πλέον στα στοιχεία για την Ελλάδα. Να θυμίσουμε ότι τότε, ο ΕΟΦ (ή μάλλον η PwC) ανέφερε στο έγγραφο της φαρμακοεπαγρύπνησης ότι για την κατηγορία των αναφορών με θανατηφόρο έκβαση, τα δεδομένα εξετάζονται κατά προτεραιότητα απο την ΟΕ/E. ΕΦΑΡ (Εθνική Επιτροπή Φαρμακοεπαγρύπνησης). Για τη συγκεκριμένη αναφορά τότε του 15χρονου, δεν κατέστη από τον ΕΟΦ δυνατή η αξιολόγησή της και τέθηκε σε “κατάσταση μη αξιολογήσιμη” (unassessable).

Αυτό βέβαια που δεν αναφέρεται είναι εάν προηγήθηκε η αξιολόγηση των
δεδομένων και εάν ο ΕΟΦ ζήτησε περισσότερα στοιχεία για το συγκεκριμένο θανατηφόρο συμβάν.
Σύμφωνα
με τον Οργανισμό, η κατάσταση conditional αφορά τις αναφορές που δεν
έχει ολοκληρωθεί ακόμα η αξιολόγησή τους διότι αναμένονται
συμπληρωματικά στοιχεία (π.χ πορίσματα ιατροδικαστικών εκθέσεων). Το
ερώτημα εδώ που προκύπτει είναι αν ο Οργανισμός έθεσε τότε τη
συγκεκριμένη αναφορά πρώτα σε κατάσταση conditional και μετά σε
unassessable. Ζήτησε συμπληρωματικά στοιχεία για την συγκεκριμένη αναφορά;
Πρόκειται άραγε για το ίδιο περιστατικό; Αποφάσισε ο ΕΟΦ να επανεξετάσει το θέμα;
Ή είναι μία νέα αναφορά θανάτου ανηλίκου που έχει άμεση σχέση με τα προϊόντα κατά της Covid;
Όσον αφορά τις αναφορές που είχαν ως έκβαση το θάνατο και αφορούν τα συγκεκριμένη προϊόντα, η εικόνα έχει ως εξής:
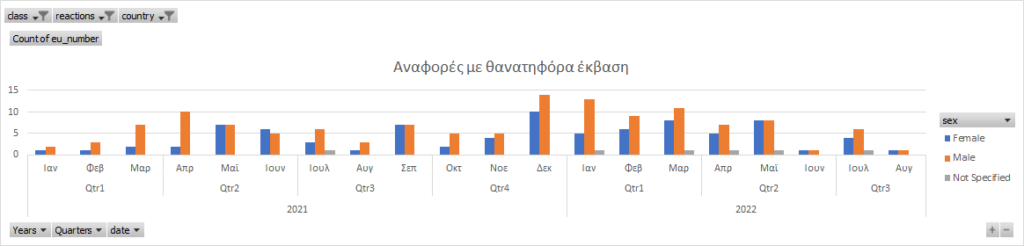
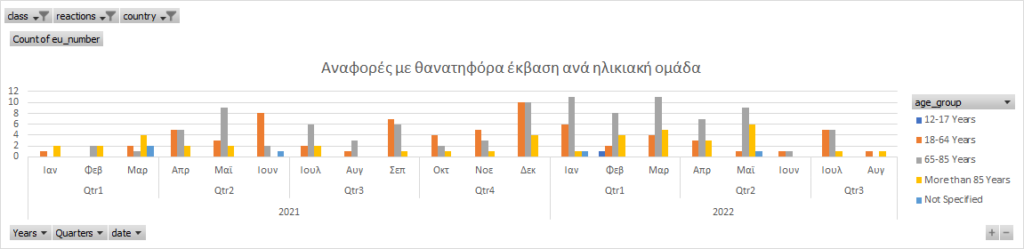
Οι τελευταίες 30 αναφορές οι οποίες είχαν έκβαση το θάνατο είναι οι ακόλουθες (σας παραθέτουμε το σύνδεσμο με την αναφορά στον ΕΜΑ):
για την συνέχεια της ανάρτησης εδώ

Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου