
Πριν από μερικές εβδομάδες, είχαμε αναφερθεί σε δύο συστατικά τα οποία περιέχονται στο πειραματικό σκεύασμα (BNT162b2) των εταιρειών BioNTech/Pfizer. Πρόκειται για τα συστατικά ALC-0315 και ALC-0159 τα οποία σύμφωνα με τον κατασκευαστή και προμηθευτή τους(η εταιρεία Echelon Biosciences), είναι μόνο για ερευνητικούς σκοπούς και όχι για ανθρώπινη χρήση.
Για το συγκεκριμένο θέμα ρωτήσαμε τον Ευρωπαϊκό Οργανισμό Φαρμάκων ο οποίος μας απάντησε, όπως μας συνηθίζει, γενικά και αόριστα και μας παρέπεμψε να διαβάσουμε έκθεση αξιολόγησης(Assessment Report-EPAR) για το προϊόν Comirnaty.

Τα χημικά συστατικά είναι γενικά διαθέσιμα από διάφορους προμηθευτές σε διαφορετικές περιεκτικότητες ή παράγονται σύμφωνα με διαφορετικά πρότυπα. Τα συστατικά που προορίζονται να χρησιμοποιηθούν σε ένα φάρμακο παράγονται με διαφορετικά πρότυπα από την ίδια ουσία που χρησιμοποιείται για εργαστηριακούς ή βιομηχανικούς σκοπούς. Τα πρότυπα ποιότητας στα οποία ελέγχονται τα επιμέρους έκδοχα καθορίζονται στην αντίστοιχη άδεια κυκλοφορίας του προϊόντος. Ο EMA δεν ελέγχει αυτά τα επιμέρους συστατικά. Ωστόσο, ένα πολύ
σημαντικό μέρος των δεδομένων που πρέπει να παρέχει κάθε παρασκευαστής φαρμάκων σε ρυθμιστικές αρχές όπως ο EMA αφορά την ποιότητα του προϊόντος και των επιμέρους συστατικών του, καθώς και την απόδειξη ότι εφαρμόζονται οι απαραίτητες διαδικασίες παρασκευής και έλεγχοι για τη διατήρηση της ποιότητας κάθε παρτίδας του φαρμάκου. Αυτό σημαίνει ότι τα δεδομένα που υποστηρίζουν τη χρήση αυτών των συστατικών και τα πρότυπα που πρέπει να πληρούν πριν από τη χρήση τους σε κάθε παρτίδα προϊόντος, αξιολογούνται και εγκρίνονται από τον EMA πριν από την έγκριση κυκλοφορίας.
Η ποιότητα των ALC-0315 και ALC-0159 που χρησιμοποιούνται ως έκδοχα στο Comirnaty έχει αποδειχθεί ότι είναι κατάλληλη για την προβλεπόμενη χρήση και είναι σύμφωνη με τις σχετικές επιστημονικές κατευθυντήριες γραμμές και τα πρότυπα που προβλέπει ο EMA για όλα τα φάρμακα.
Για πληροφορίες σχετικά με αυτά τα έκδοχα, ανατρέξτε στην EPAR.
Οι μη κλινικές μελέτες που πραγματοποιήθηκαν με τα ALC-0315 και ALC-0159 εξετάζονται στην έκθεση αξιολόγησης του EMA για το Comirnaty.
Εμείς διαβάσαμε και τις 140 σελίδες της έκθεσης αξιολόγησης και από την απάντηση του οργανισμού προκύπτουν αρκετά ερωτήματα για τα οποία, με επερώτηση, ζητάμε από τον ΕΜΑ να μας διευκρινίσει. Αξίζει να σημειωθεί οτι ο οργανισμός “έκλεισε” μετά την απάντησή του το θέμα(διεύθυνση no-reply) χωρίς να μας δώσει την ευκαιρία να υπάρξει ένας εποικοδομητικός διάλογος. Εμείς βρήκαμε την ηλεκτρονική διεύθυνση του συγκεκριμένου κυρίου(γνωστός και στην Ελλάδα από την σχετικά πρόσφατη επίσκεψή του στη χώρα μας) και για να είμαστε σίγουροι, δημιουργήσαμε νέα αίτηση προς απάντηση στον οργανισμό. Η απάντησή μας προς τον ελεγκτικό οργανισμό είναι η εξής:
Αξιότιμε κύριε Burgos,
σας ευχαριστούμε για την απάντησή σας. Δυστυχώς, δεν μας δώσατε την
ευκαιρία να απαντήσουμε και φαίνεται ότι έχετε κλείσει το ticket
ASK-103595.
Έτσι, θα προσπαθήσουμε να επικοινωνήσουμε απευθείας μαζί σας και να
απαιτήσουμε να ανοίξετε ξανά το ticket ώστε να μας απαντήσετε σε αυτό το
πολύ κρίσιμο θέμα.
Αντιλαμβανόμαστε ότι ο EMA δεν δοκιμάζει αυτά τα μεμονωμένα συστατικά και οι αποφάσεις σας βασίζονται μόνο στα δεδομένα που παρέχει ή θέλει να παράσχει ο κατασκευαστής στη ρυθμιστική αρχή(ΕΜΑ).
Στο έγγραφο EPAR που μας στείλατε, διαβάζουμε στη σελίδα 45:
Τα επίπεδα των ALC-0315 και ALC-0159 στο πλάσμα, το ήπαρ, τα ούρα και τα κόπρανα αναλύθηκαν(σε αρουραίους Wistar Han) με LC-MS/MS(σ.σ: Υγρή χρωματογραφία-φασματομετρία μάζας) σε διαφορετικές χρονικές στιγμές έως και 2 εβδομάδες. Τα ALC-0315 και ALC-0159 απομακρύνθηκαν ταχέως από το πλάσμα κατά τις πρώτες 24 ώρες με αρχικό t½ 1,62 και 1,72 ώρες, αντίστοιχα. 24 ώρες μετά τη χορήγηση, παρέμεινε λιγότερο από το 1% των μέγιστων συγκεντρώσεων στο πλάσμα. Ένας βραδύτερος ρυθμός κάθαρσης παρατηρήθηκε μετά από 24 ώρες με τελικό t½ αποβολής του ALC-0315 και του ALC-0159 139 και 72,7 ώρες, αντίστοιχα.
Μετά την κάθαρση στο πλάσμα, το ήπαρ φαίνεται να είναι το κύριο όργανο στο οποίο διανέμονται τα ALC-0315 και ALC-0159. Ο υποψήφιος (σ.σ η BioNTech) εκτίµησε ότι το ποσοστό της δόσης που κατανέµεται στο ήπαρ είναι ~60% για την ALC-0315 και ~20% για την ALC-0159. Η παρατηρούμενη κατανομή στο ήπαρ είναι σύμφωνη με τις παρατηρήσεις από τη μελέτη βιοκατανομής και την τοξικολογία επαναλαμβανόμενων δόσεων, και οι δύο με τη χρήση ΙΜ(Ενδομυϊκής) χορήγησης.
Για το ALC-0315 (αμινολιπίδιο), η μέγιστη συγκέντρωση που ανιχνεύθηκε στο ήπαρ (294 μg/g ήπατος) επιτεύχθηκε 3 ώρες μετά την ενδοφλέβια έγχυση. Το ALC-0315 αποβαλλόταν αργά από το ήπαρ και μετά από 2 εβδομάδες η συγκέντρωση του ALC-0315 ήταν ακόμη ~25% της μέγιστης συγκέντρωσης, γεγονός που υποδεικνύει ότι το ALC-0315 θα αποβαλλόταν από το ήπαρ των αρουραίων σε περίπου 6 εβδομάδες. Για το ALC-0159 (PEG-λιπίδιο), η μέγιστη συγκέντρωση που ανιχνεύθηκε στο ήπαρ (15,2 μg/g ήπατος) επιτεύχθηκε 30 λεπτά μετά την ενδοφλέβια έγχυση.
Το ALC-0159, αποβλήθηκε από το ήπαρ ταχύτερα από το ALC-0315 και μετά από 2 εβδομάδες η συγκέντρωση του ALC-0159 ήταν μόνο ~0,04% της μέγιστης ανιχνευθείσας συγκέντρωσης. Ζητήθηκε από τον αιτούντα(BioNTech) να εξετάσει τον μακρύ χρόνο ημιζωής του ALC-0315 και την επίδρασή του, να συζητήσει τη σύγκριση με την πατισιράνη, καθώς και τον αντίκτυπο των ενισχυτικών και τη δμεταθεραπευτική διάρκεια. Ο αιτών(BioNTech) έκρινε ότι δεν υπήρχαν μη κλινικά ζητήματα ασφάλειας με βάση τις μελέτες τοξικότητας επαναλαμβανόμενων δόσεων σε δόσεις (σε mg/kg βάση) πολύ μεγαλύτερες από αυτές που χορηγούνται στον άνθρωπο- αυτό ήταν αποδεκτό από την CHMP(Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση).
Επομένως, παρατηρούμε ότι τα συστατικά του παρασκευάσματος διανέμονται πολύ γρήγορα σε όλο το σώμα. Το ALC-0315 παραμένει στο ήπαρ για περίπου 6 εβδομάδες. Ωστόσο, αυτό δεν μετρήθηκε, αλλά μόνο υπολογίστηκε.
Σε έναν λεπτομερή κατάλογο, τον οποίο ο Dr. Peter F. Mayer έλαβε ύστερα από αίτηση σύμφωνα με το Άρθρο 7 του κανονισμού (ΕΚ) αριθ. 1049/2001 σχετικά με την πρόσβαση του κοινού στα έγγραφα του Ευρωπαϊκού Κοινοβουλίου, του Συμβουλίου και της Επιτροπής 1 και το τμήμα 3 του παραρτήματος της “πολιτικής του Ευρωπαϊκού Οργανισμού Φαρμάκων για την πρόσβαση στα έγγραφα – ΠΟΛΙΤΙΚΗ/0043” , θα βρείτε τις λεπτομέρειες σχετικά με αυτά τα συστατικά. Ακολουθεί η γραφική απεικόνιση της συγκέντρωσης των δύο λιπιδίων στο ήπαρ των αρουραίων σε συνάρτηση με το χρόνο σύμφωνα με τα επίσημα έγγραφα του κατασκευαστή.
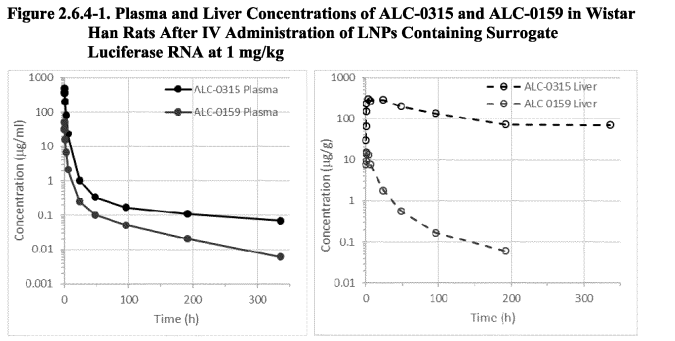
Βλέπουμε ότι ιδίως το λιπίδιο ALC-0135 παραμένει για πολύ μεγάλο χρονικό διάστημα στο αίμα και στο ήπαρ. Η αποσύνθεσή του, ιδίως στο ήπαρ (εικόνα δεξιά), φαίνεται να είναι εξαιρετικά αργή και να σταματά ουσιαστικά μετά από περίπου 3 ημέρες. Αυτό έρχεται σε αντίθεση με τους ισχυρισμούς που αναφέρονται στην έκθεση EPAR που μας αποστείλατε ότι τα συστατικά αποβάλλονται γρήγορα.
Μπορείτε να βρείτε τα έγγραφα εδώ(από την ιστοσελίδα του Dr. Peter Mayer):
Ενότητα 2.6.4 Φαρμακοκινητική – https://www.eyewideopen.org/wp-content/uploads/2022/01/R-pharmkin-written-summary.pdf
Ενότητα 2.6.5 Φαρμακοκινητική σε μορφή πίνακα – https://www.eyewideopen.org/wp-content/uploads/2022/01/4373.R-pharmkin-tabulated-summary.pdf
Περαιτέρω έρευνες και θεωρητικοί υπολογισμοί και αξιολογήσεις περιλαμβάνονται επίσης στην έκθεση.
Αναφέρατε ότι η ποιότητα των ALC-0315 και ALC-0159 που χρησιμοποιούνται ως έκδοχα στο Comirnaty έχει αποδειχθεί ότι είναι κατάλληλη για την προβλεπόμενη χρήση και είναι σύμφωνη με τις σχετικές επιστημονικές κατευθυντήριες γραμμές του EMA και τα πρότυπα που αναμένονται για όλα τα φάρμακα.
Η πρώτη μας ερώτηση είναι, πώς ακριβώς αποδεικνύεται η ποιότητα εάν δεν έχετε όλα τα στοιχεία και τα δεδομένα που αναφέρονται στην έκθεση EPAR δεν είναι σύμφωνα με τα στοιχεία του κατασκευαστή;
Και για τις δύο ουσίες, δόθηκαν όροι για την παροχή περαιτέρω πληροφοριών, και συγκεκριμένα οι SO4 και SO5 (SO = Specific Obligation/Ειδική Υποχρέωση). Σύμφωνα με το έγγραφο EPAR που μας στείλατε, σελίδα 36:
SO1: Προκειμένου να ολοκληρωθεί ο χαρακτηρισμός της δραστικής ουσίας και του τελικού προϊόντος, ο ΚΑΚ(Κάτοχος Άδειας Kυκλοφορίας) θα πρέπει να παράσχει πρόσθετα δεδομένα. Καταληκτική ημερομηνία: Ιούλιος 2021. Ενδιάμεσες εκθέσεις: Μάρτιος 2021.
SO2: Προκειμένου να διασφαλιστεί η σταθερή ποιότητα του προϊόντος, ο ΚΑΚ θα πρέπει να παράσχει πρόσθετα στοιχεία για τη βελτίωση της στρατηγικής ελέγχου, συμπεριλαμβανομένων των προδιαγραφών της δραστικής ουσίας και του τελικού προϊόντος. Καταληκτική ημερομηνία: Ιούλιος 2021. Ενδιάμεσες εκθέσεις: Μάρτιος 2021.
SO3: Προκειμένου να επιβεβαιωθεί η συνέπεια της διαδικασίας παρασκευής του τελικού προϊόντος, ο ΚΑΚ θα πρέπει να παρέχει πρόσθετα δεδομένα επικύρωσης. Προθεσμία: Μάρτιος 2021.
SO4: Προκειμένου να επιβεβαιωθεί το προφίλ καθαρότητας και να διασφαλιστεί ο ολοκληρωμένος ποιοτικός έλεγχος και η συνέπεια από παρτίδα σε παρτίδα καθ’ όλη τη διάρκεια του κύκλου ζωής του τελικού προϊόντος, ο ΚΑΚ θα πρέπει να παράσχει πρόσθετες πληροφορίες σχετικά με τη συνθετική διαδικασία και τη στρατηγική ελέγχου για το έκδοχο ALC-0315. Καταληκτική ημερομηνία: Ιούλιος 2021, Ενδιάμεσες εκθέσεις: Ιανουάριος 2021, Απρίλιος 2021.
SO5: Προκειμένου να επιβεβαιωθεί το προφίλ καθαρότητας και να διασφαλιστεί ο ολοκληρωμένος ποιοτικός έλεγχος και η συνέπεια από παρτίδα σε παρτίδα καθ’ όλη τη διάρκεια του κύκλου ζωής του τελικού προϊόντος, ο ΚΑΚ θα πρέπει να παράσχει πρόσθετες πληροφορίες σχετικά με τη συνθετική διαδικασία και τη στρατηγική ελέγχου για το έκδοχο ALC-0159. Καταληκτική ημερομηνία: Ιούλιος 2021, Ενδιάμεσες εκθέσεις: Ιανουάριος 2021, Απρίλιος 2021.
Στις επόμενες σελίδες του συγκεκριμένου εγγράφου περιγράφονται λεπτομερέστερα οι πληροφορίες και οι αξιολογήσεις που πρέπει να παρέχονται και να διενεργούνται.
Στην Έκθεση Αξιολόγησης (https://www.ema.europa.eu/en/documents/variation-report/comirnaty-h-c-5735-r-0046-epar-assessment-report-renewal_en.pdf ) για την παράταση κατά ένα έτος της υπό όρους άδειας κυκλοφορίας με ημερομηνία 3.11.2021, υπάρχουν ορισμένες πληροφορίες σχετικά με την κατάσταση των SO(Ειδικών Υποχρεώσεων του κατασκευαστή)στη σελίδα 11.
Για την SO4 όσον αφορά την ALC-0315 καθώς και για την SO5 όσον αφορά την ALC-0159, πληρούνται μόνο μερικές πτυχές, καθώς οι περισσότερες από τις απαιτούμενες αξιολογήσεις εκκρεμούν ακόμη. Ωστόσο, σύμφωνα με την υποχρέωση, οι σχετικές πληροφορίες και τα δεδομένα θα έπρεπε να έχουν υποβληθεί έως τον Ιούλιο του 2021.
Τα δεδομένα για την εκπλήρωση των υπόλοιπων τμημάτων αυτών των SO έχουν
υποβληθεί με την παραλλαγή EMEA/H/C/C/005735/II/0054/G και βρίσκονται
επί του παρόντος υπό αξιολόγηση από την CHMP.
Η δεύτερη ερώτησή μας είναι: Πώς αποδεικνύεται η ποιότητα αυτών των προϊόντων στον EMA, εάν δεν έχετε τα δεδομένα από τον κατασκευαστή και οι προθεσμίες που έχει θέσει ο EMA έχουν παρέλθει;
Αναμένουμε τις απαντήσεις το συντομότερο δυνατόν.
Σας ευχαριστούμε εκ των προτέρων
Με εκτίμηση
E.Y.E. – Επιστήμονες για την Υγεία και την Ελευθερία
Όπως βλέπετε, ο ΕΜΑ δεν έχει ασχοληθεί με το θέμα εδώ και μήνες και η
κατασκευάστρια εταιρεία δεν έχει ακόμα παραδώσει τα απαιτούμενα
δεδομένα που χρειάζονται ώστε το προϊόν να λάβει την, υπό όρους, άδεια
κυκλοφορίας. Αναμένουμε με ενδιαφέρον την απάντηση του οργανισμού και
ελπίζουμε αυτή τη φορά να μας απαντήσει με ειλικρίνεια και περισσότερα
στοιχεία.
Μία “πικάντικη” λεπτομέρεια: Αν αναλύσει κάποιος τα μεταδεδομένα του
εγγράφου EPAR, διαπιστώνει ότι την έκθεση τη συνέταξε η κυρία Vanessa
Seguin, Scientific Administrator στον ΕΜΑ, πρώην υπεύθυνη Ευρωπαϊκών ρυθµιστικών υποθέσεων στην εταιρεία Johnson & Johnson.
Ημερομηνία δημοσίευσης: 23.01.2022
Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου